科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-05-22
脂质体,特别是阳离子脂质体,是目前应用最广泛的药物/基因递送纳米载体。在血清环境中,脂质体会不可避免地吸附蛋白质等生物分子,形成“蛋白冠”结构。在最近发表于《国家科学评论》(National Science Review, NSR)的文章中,国家纳米科学中心梁兴杰研究团队发现,蛋白冠结构会影响纳米载体的界面性质,使脂质体跨越细胞膜的方式从非能量依赖的膜融合机制转变为能量依赖的内吞机制。
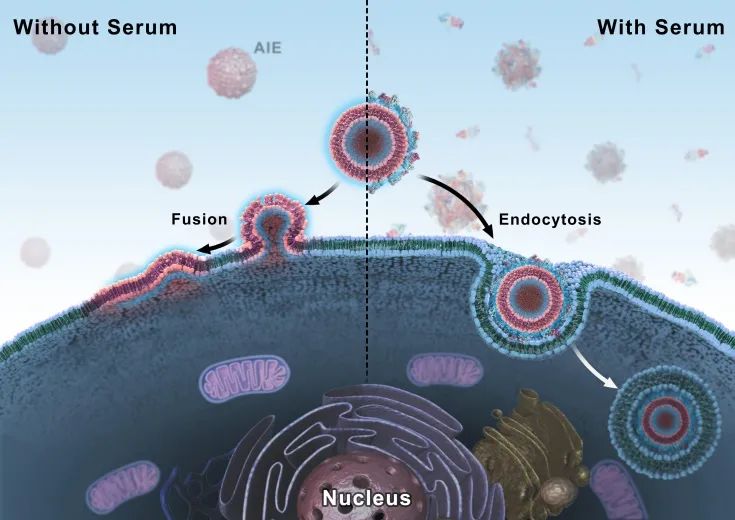 蛋白冠介导的阳离子脂质体与细胞膜相互作用
蛋白冠介导的阳离子脂质体与细胞膜相互作用
首先,为了可视化示踪阳离子脂质体与细胞膜的相互作用,研究团队设计合成了一种正电性的脂质膜探针TR4分子(见下图)。TR4分子的结构包含几个部分:棕榈酸链使TR4分子可锚定在磷脂层中;四个精氨酸增加TR4分子水溶性,并将阴离子脂质体反转为阳离子脂质体TR4@Lipo(下图b);TPE分子具有聚集诱导发光特性,赋予阳离子脂质体自示踪特性。
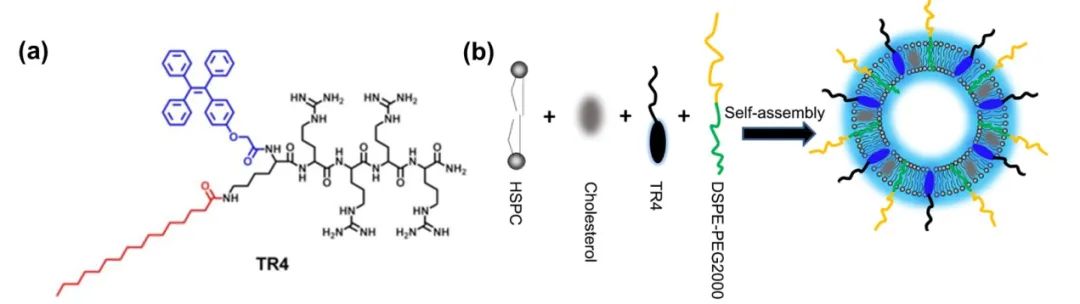 (a)TR4分子结构图;(b) TR4@Lipo阳离子脂质体的结构示意图。
(a)TR4分子结构图;(b) TR4@Lipo阳离子脂质体的结构示意图。
研究表明,在无血清条件下,TR4@Lipo通过非能量依赖的膜融合方式与细胞膜结合。但是,在人血清、胎牛血清或白蛋白等条件下,细胞主要通过能量依赖的内吞方式摄取TR4@Lipo(下图a)。研究者对胎牛血清浓度进行调节,发现膜融合过程转变为内吞过程的临界蛋白浓度在0.30%左右(下图b)。
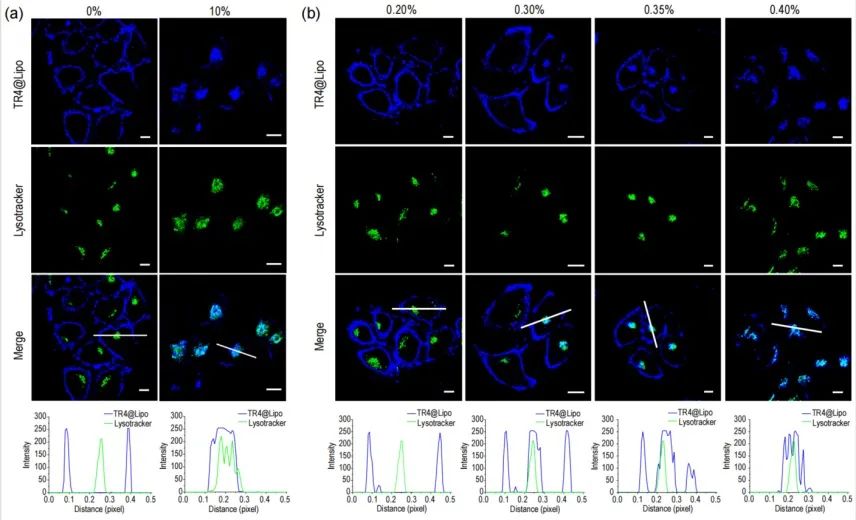
(a)无FBS条件下和10%FBS条件下TR4@Lipo和溶酶体共定位分析;(b)不同FBS浓度比例时TR4@Lipo和溶酶体共定位分析。
进一步研究表明,阳离子脂质体的蛋白冠结构还会影响其递送药物分子的亚细胞分布。在无血清条件下,脂质体递送的游离抗肿瘤药物阿霉素(DOX)主要分布于细胞核和溶酶体中,阴离子脂质体递送的DOX主要分布于溶酶体,而TR4@Lipo递送的DOX主要分布于细胞核;在血清条件下,TR4@Lipo递送的DOX主要分布于溶酶体(见下图)。
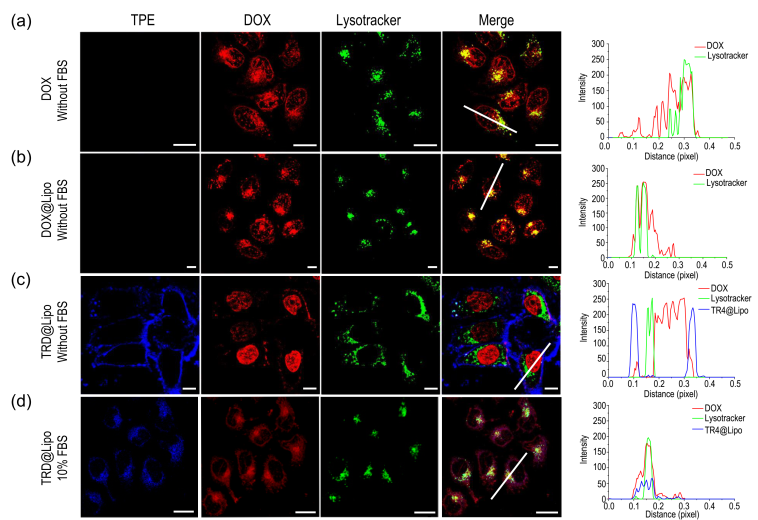
共聚焦显微镜分析不同条件下DOX和脂质体的亚细胞分布。(a)无FBS条件下游离DOX;(b)无FBS条件下正常的DOX@Lipo; (c) 无FBS条件下TRD@Lipo; (d)10% FBS条件下的TRD@Lipo。该研究报道了蛋白冠对细胞转运阳离子纳米脂质体机制的调控,有助于深入理解复杂生理环境下纳米-生物界面的相互识别和作用机制。同时,该研究对阳离子脂质体的体外和临床应用等具有重要的参考意义。
该项工作得到了国家自然科学基金中爱(NSFC-SFI)国际合作项目、国家自然科学基金中德国际合作项目、国家自然科学基金面上项目、中科院战略性先导专项等项目的支持。
来源: 中国科学杂志社
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQ5MzQyNA==&mid=2656811228&idx=1&sn=f82573bb418de82ef9fd7c4fe696d12f
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
寻求企业进行流体芯片设计和原型验证
开尔文探针力显微镜
暗场显微镜
皮肤涂片显微镜检查
胃液显微镜检查
卫生部关于印发《“十二五”时期康复医疗工作指导意见》的通知
关于做好四川芦山地震伤员早期康复工作的紧急通知

张锋跨界发明DNA显微镜,彻底改造显微镜
云南省康复医学会鲁甸“8·03”地震康复医疗救助行动报告
导电粒子显微镜